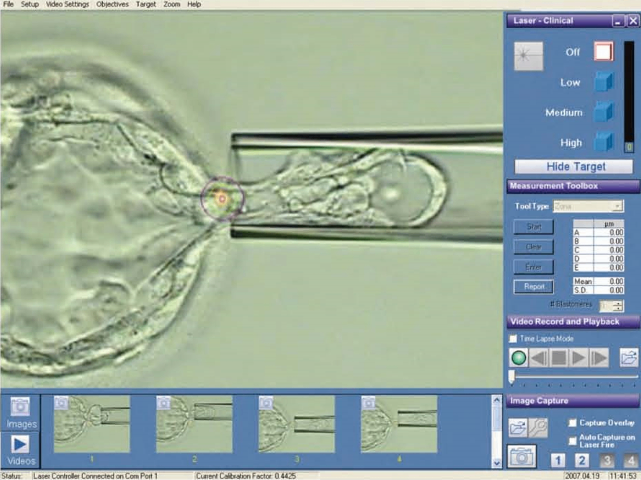
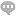纺锤体功能分解在细胞分裂中,其主要作用有两个部分。其一为排列与分裂染色体。纺锤体的完整性决定了染色体分裂的正确性。纺锤体的正常生成是染色体排列的必要条件。纺锤体生成完毕后一般会有5-20分钟的延迟,以供细胞调整着丝点上微管束的极性,以及决定是否所有的着丝点都附着正确。此后细胞进入分裂后期,染色体分裂为两组数目相等的姐妹染色单体。同样,纺锤体的完整性决定这个分裂过程在时间和空间上的准确性。纺锤体另一功能为决定胞质分裂的分裂面。染色体分裂的同时,纺锤体中的一部分微管不随染色体分裂到两极,而停弛在纺锤体**,形成纺锤**体(centralspindle)。在纺锤中体的**为两组极性相反的微管交叠的区域,称为纺锤**区(spindlemidzone).此**区就是接下来的胞质分裂面。胞质分裂开始于分裂后期的较晚期。胞质分裂一般结束于分裂末期后1-2小时,此期间两个子细胞由中心颗粒体(midbody)连接。一般认为纺锤体的分解发生在细胞分裂末期。纺锤体微管的正极朝向细胞两极,负极则靠近染色体。北京Hamilton Thorne纺锤体揭示卵母细胞关键结构

纺锤体成像技术的中心在于提高成像的分辨率和速度,以捕捉纺锤体的精细结构和动态变化。以下是几种主要的纺锤体成像技术的技术原理:结构光照明显微镜(SIM):SIM通过引入已知的空间调制光场,使样品发出具有特定空间频率的荧光信号。通过采集多个不同空间频率的荧光图像,并利用算法进行重建,SIM可以实现超越传统荧光显微镜分辨率的成像。这种方法不仅提高了成像的分辨率,还保持了较快的成像速度和较好的细胞活性。受激辐射损耗显微镜(STED):STED利用一束聚焦的激光束(称为STED束)来抑制样品中特定区域的荧光信号。通过精确控制STED束的位置和强度,STED可以实现超越衍射极限的成像分辨率。这种方法特别适用于观测纺锤体等复杂结构中的精细细节。单分子定位显微镜(SMLM):SMLM通过检测样品中单个荧光分子的位置来实现高分辨率成像。由于荧光分子的随机闪烁特性,SMLM可以在时间域上分离不同分子的荧光信号,从而实现对单个分子的精确定位。这种方法不仅提高了成像的分辨率,还提供了对纺锤体中单个微管和蛋白质分子的动态变化的观测能力。北京Hamilton Thorne纺锤体揭示卵母细胞关键结构纺锤体微管的动态变化是细胞分裂周期的重要标志。

近年来,随着玻璃化冷冻技术的不断发展,成熟卵母细胞纺锤体的冷冻保存研究取得了进展。研究表明,采用玻璃化冷冻法冷冻保存的成熟卵母细胞,在解冻后其纺锤体和染色体的形态及功能均能得到较好的保持。这主要得益于玻璃化冷冻过程中避免了冰晶形成对细胞的损伤,以及冷冻保护剂对细胞的有效保护。然而,值得注意的是,尽管玻璃化冷冻法在提高解冻存活率和妊娠成功率方面取得了成效,但仍存在一些问题。例如,冷冻过程中纺锤体的微管结构可能受到低温的影响而发生解聚,导致染色体分离异常。此外,冷冻保护剂的毒性也可能对卵母细胞造成一定的损伤。为了克服这些问题,研究者们进行了大量的实验和优化工作。例如,通过改进冷冻保护剂的配方和浓度,降低其对细胞的毒性;通过优化冷冻速率和程序,减少冷冻过程中对细胞的机械损伤;以及通过筛选和评估不同冷冻载体和保存时间对卵母细胞冷冻效果的影响,寻找好的冷冻保存条件。
纺锤体的形成是一个复杂而精细的过程,涉及多种蛋白质的参与和调控。在有丝分裂的前间期,细胞进入S期,中心体开始复制倍增,为接下来的纺锤体形成做准备。进入G2期后,中心体完成复制,并在细胞进入分裂前期时分离,每个中心体各自形成放射状排列的微管,即星体。这些微管通过持续增加和丢失组成微管的微管蛋白亚基,实现微管的聚合和解聚,使纺锤体得以形成和维持。微管的组装和去组装过程受到多种调节蛋白的精确调控,如蛋白激酶、磷酸酶等。这些调节蛋白能够影响微管蛋白的聚合和解聚速率,从而控制纺锤体的形态和稳定性。此外,纺锤体的形成还依赖于动粒微管与染色体动粒的结合,这一过程由动粒上的驱动蛋白和动力蛋白介导,确保了染色体能够被纺锤体正确地捕获和牵引。纺锤体的功能异常可能导致细胞分裂错误,引发遗传疾病。

尽管纺锤体成像技术已经取得了明显的进展,但仍存在一些挑战和限制。例如,目前的高分辨率成像技术往往需要对样品进行特殊处理或标记,这可能会对细胞的活性和功能产生影响。此外,成像速度和分辨率之间仍存在权衡关系,如何在保持高分辨率的同时提高成像速度是当前研究的重点之一。未来,随着成像技术的不断创新和进步,纺锤体成像技术有望实现更高的分辨率、更快的成像速度和更好的细胞活性保持能力。例如,基于量子点的荧光标记技术、基于人工智能的图像重建算法以及基于超快激光的成像技术等都有望为纺锤体成像技术的发展带来新的突破。此外,结合其他细胞生物学技术,如基因编辑、蛋白质组学等,纺锤体成像技术将能够更深入地揭示细胞分裂的复杂机制和纺锤体的功能作用。纺锤体在细胞分裂过程中展现出惊人的自我组装能力。北京哺乳动物纺锤体揭示卵母细胞关键结构
纺锤体的形成与细胞骨架的重构密切相关。北京Hamilton Thorne纺锤体揭示卵母细胞关键结构
染色体当细胞从间期进入有丝分裂期,间期细胞微管网络解聚为游离的αβ-微管蛋白二聚体,再重组成纺锤体,介导染色体的运动;分裂末期纺锤体微管解聚,又重组形成细胞质微管网络。可分为:动粒微管:连接染色体动粒于两极的微管。极间微管:从两极发出,在纺锤体中部赤道区相互交错的微管。星体微管:中心体周围呈辐射分布的微管。染色体的运动依赖纺锤体微管的组装和去组装。在这一过程中动粒微管与动粒之间的滑动主要是依靠结合在动粒部位的驱动蛋白和动力蛋白沿微管的运动来完成。极微管在纺锤体中部交错,有些分布在极微管之间特殊的双极马达蛋白,其中2个马达蛋白沿一条微管运动,另2个马达结构域沿另一条微管运动。由于2条微管分别来自二极,故极性相反。当双极驱动蛋白四聚体沿微管向正极运动时,纺锤体二极间距离延长。反之纺锤体距离缩短。北京Hamilton Thorne纺锤体揭示卵母细胞关键结构
文章来源地址: http://yiqiyibiao.smdnjgsb.chanpin818.com/swyqxm/qtswyq/deta_27557478.html
免责声明: 本页面所展现的信息及其他相关推荐信息,均来源于其对应的用户,本网对此不承担任何保证责任。如涉及作品内容、 版权和其他问题,请及时与本网联系,我们将核实后进行删除,本网站对此声明具有最终解释权。



 [VIP第1年] 指数:3
[VIP第1年] 指数:3